南湖新闻网讯(通讯员 陶诗煜)近日,我校猪功能微生物组研究团队针对肠道特定益生菌通过其衍生的胞外囊泡(Extracellular vesicles, EVs)修复仔猪肠道损伤这一领域开展了系统深入研究,在国际学术期刊Environment International,Journal of Advanced Research和npj Biofilms Microbiomes等杂志上发表了系列研究论文,揭示了腹泻仔猪紊乱的肠道菌群介导肠道屏障功能损伤的分子机制,阐明了益生菌源EVs调控巨噬细胞分型增强肠道屏障功能的作用机制。
腹泻导致仔猪肠道屏障功能受损,肠黏膜通透性增加,诱发肠道炎症,降低对病原感染的抵抗力,最终导致生长迟缓,给养猪业带来巨大损失。针对仔猪腹泻这一难题,研究团队通过宏基因组学技术揭示了不同健康状态下新生和断奶仔猪肠道细菌和噬菌体特征:新生和断奶期的健康与腹泻仔猪的微生物结构之间存在巨大差异,黏膜乳杆菌和约氏乳杆菌分别是区分新生和断奶期仔猪健康和腹泻的关键菌;一些特定的差异病毒可能是区分仔猪腹泻和健康的关键生物标志物。研究还基于无菌小鼠和粪菌移植技术进一步阐明了腹泻仔猪肠道屏障功能损伤与肠道菌群的关联机制:腹泻仔猪受体小鼠生长速率降低、空肠绒毛发育受阻且结肠组织病理学评分升高、肠黏膜紧密连接蛋白表达降低、肠上皮细胞凋亡程度增加而增殖能力降低,肠黏膜中炎性调节因子NF-κB和MAPK信号通路关键蛋白表达均有不同程度升高,炎症型M1巨噬细胞maker基因丰度显著升高。上述研究为腹泻仔猪紊乱的肠道菌群导致肠道屏障功能障碍这一科学假设提供了直接证据。
基于益生菌干预技术调节肠道黏膜免疫是促进仔猪肠道屏障功能的有效策略。由于肠上皮屏障的阻隔,益生菌通常通过分泌生物活性物质参与其与宿主之间的相互作用。EVs是细菌在生长过程中释放的具有双层膜纳米结构的衍生物,其通过运输和传递调节宿主信号通路和细胞过程的效应分子影响宿主健康。为了探索益生菌及其衍生的EVs是否能够缓解仔猪肠道屏障功能损伤,研究团队从健康仔猪粪便样品中分离培养了黏膜和约氏乳杆菌、提取鉴定了两种乳杆菌衍生的EVs并进行了体内外功能验证。研究显示:黏膜和约氏乳杆菌均可有效缓解LPS诱导的仔猪肠道形态结构破坏,抑制炎性细胞因子分泌,增加紧密连接蛋白表达;体外细胞试验表明两种乳杆菌及其衍生的EVs均可逆转LPS诱导的仔猪肠上皮细胞屏障损伤。此外,两种乳杆菌及其分泌的EVs也均有效缓解由腹泻仔猪粪菌悬液和ETEC K88所致的小鼠体重降低,恢复肠道形态结构,降低血清和肠道组织中促炎细胞因子含量和肠道通透性,增加紧密连接蛋白表达。该研究明确了猪源乳酸菌及其衍生的EVs具有缓解仔猪肠道屏障功能损伤的良好效果,为进一步基于巨噬细胞分型探讨益生菌源EVs缓解仔猪肠道屏障功能损伤的深层次原因奠定基础(图1)。
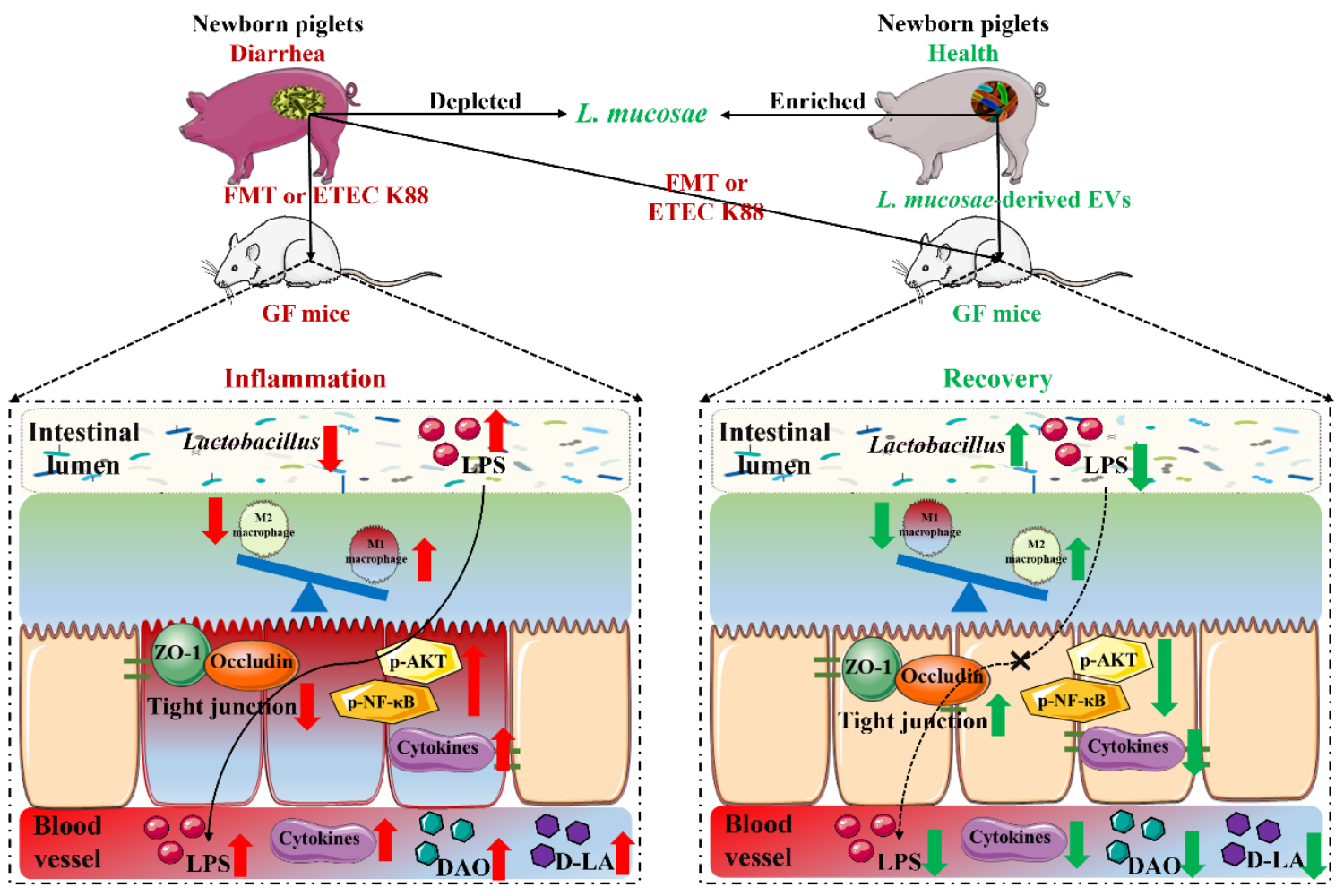
图1 黏膜乳杆菌EVs调节巨噬细胞表型维持肠道稳态
巨噬细胞作为启动和调控炎症反应的核心细胞,其分型转化对于维持肠道屏障功能至关重要。研究团队发现,黏膜和约氏乳杆菌的EVs在体外促进了猪巨噬细胞由M1向M2的分型转化,这一结果也在小鼠试验中得到了验证。进一步以巨噬细胞清除小鼠为动物模型,证明了巨噬细胞是EVs缓解肠道屏障功能损伤所必需的。基于巨噬细胞与肠上皮细胞共培养体系,研究发现约氏乳杆菌分泌的EVs通过抑制ERK表达激活M2巨噬细胞极化,M2巨噬细胞通过阻断肠上皮细胞的NLRP3信号通路增强肠道屏障功能(图2)。

图2 约氏乳杆菌EVs促进M2巨噬细胞极化增强肠道屏障功能
该方面的研究从巨噬细胞与肠上皮互作的角度深度解析了乳酸菌源EVs通过促进M2巨噬细胞极化调控仔猪肠道屏障功能损伤修复的介导机制,深化了对益生菌源EVs作用机理的认知,拓展了益生菌的作用路径,对实际生产中靶向免疫细胞防治仔猪肠道屏障功能损伤提供了新策略。
此外,该研究团队长期致力于肠道微生物与宿主互作机制的研究。通过整合肠道功能微生物组与粪菌移植技术,发现了呕吐毒素通过调控特定微生物破坏肠道屏障功能;揭示了鼠乳杆菌衍生的EVs通过上调TLR2促进M2巨噬细胞极化并释放IL-10,修复由呕吐毒素引起的肠道屏障损伤,该研究为以益生菌源EVs为靶点治疗呕吐毒素引起的肠道疾病提供了新见解(图3)。
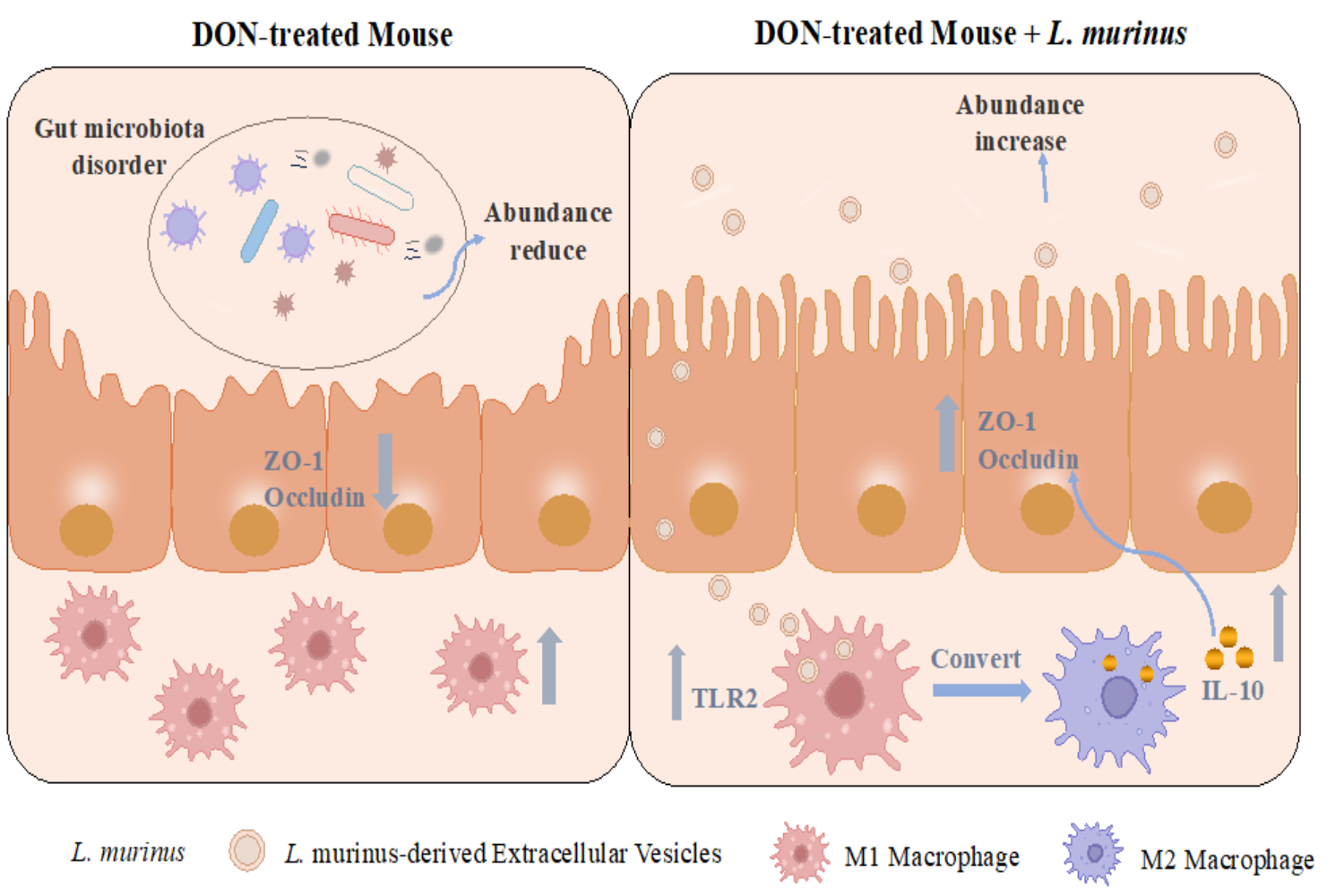
图3 鼠乳杆菌EVs缓解呕吐毒素引起的肠道屏障损伤
我校陶诗煜副研究员为系列论文的第一或通讯(含共同)作者,研究得到中国农业大学王军军教授、浙江省农业科学院杨华和肖英平研究员的支持,上述研究受到国家自然科学基金、国家重点研发计划和湖北自然科学基金的资助。
审核人 魏泓
英文摘要:The diarrheal disease causes high mortality, especially in children and young animals. The gut microbiome is strongly associated with diarrheal disease, and some specific strains of bacteria have demonstrated antidiarrheal effects. However, the antidiarrheal mechanisms of probiotic strains have not been elucidated. Here, we used neonatal piglets as a translational model and found that gut microbiota dysbiosis observed in diarrheal piglets was mainly characterized by a deficiency ofLactobacillus, an abundance ofEscherichia coli, and enriched lipopolysaccharide biosynthesis.Limosilactobacillus mucosaeandLimosilactobacillus reuteriwere a signature bacterium that differentiated healthy and diarrheal piglets. Germ-free (GF) mice transplanted with fecal microbiota from diarrheal piglets reproduced diarrheal disease symptoms. Administration ofLimosilactobacillus mucosaebut notLimosilactobacillus reuterialleviated diarrheal disease symptoms induced by fecal microbiota of diarrheal piglets and by ETEC K88 challenge. Notably,Limosilactobacillus mucosae-derived extracellular vesicles alleviated diarrheal disease symptoms caused by ETEC K88 by regulating macrophage phenotypes. Macrophage elimination experiments demonstrated that the extracellular vesicles alleviated diarrheal disease symptoms in a macrophage-dependent manner. Our findings provide insights into the pathogenesis of diarrheal disease from the perspective of intestinal microbiota and the development of probiotic-based antidiarrheal therapeutic strategies.
论文链接:
https://www.sciencedirect.com/science/article/pii/S0160412024001119?via=ihub
https://www.sciencedirect.com/science/article/pii/S2090123224001115?via=ihub
https://www.nature.com/articles/s41522-023-00403-6



























